活化蛋白C(APC)是一种抗凝血丝氨酸蛋白酶,来源于两条链,依赖于维生素K的酶原,蛋白C(3-7)。α-凝血酶和血栓调节蛋白之间的复合物催化蛋白C重链中Arg-12(牛中的Arg-14)的单裂,从而生成活化的C蛋白。几种非生理相关的蛋白酶,例如RVV-X激活剂,胰蛋白酶和PROTAC也能够激活C蛋白。
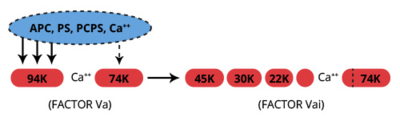
APC用作抗凝血剂,可催化辅因子Va和VIIIa因子的蛋白水解失活,从而导致凝血酶原酶和Xase因子复合物的抑制。因子Va和VIIIa的失活都是Ca2 +和磷脂依赖性的。维生素K依赖的辅因子蛋白S通过与APC形成1:1的复合物(Kd = 6x10-9M)适度提高了失活率(8)。
有几个因素减弱了APC的抗凝活性。Xa因子通过竞争因子Va上相似的结合位点来保护因子Va免受APC的蛋白水解作用。凝血酶也已被提议通过蛋白S的蛋白水解失活作为APC的调节剂。此外,APC还受循环肝素依赖性蛋白的调节C抑制剂(PAI-3),肝素非依赖性循环蛋白C抑制剂,血小板衍生的蛋白C抑制剂和PAI-1。据报道,在APC和两种PAI类型之间形成的复合物可说明在输注APC或体内产生APC时观察到的纤维蛋白溶解增加。
除了我们的标准APC制剂以外,还可以使用含有Dansyl-EGR-氯甲基甲酮的活性位点封闭形式。
活化的蛋白C是由纯化的蛋白C通过凝血酶激活,然后进行离子交换色谱法制得的(4)。APC以50%(体积/体积)甘油/水的形式提供,应储存在-20oC下。通过SDS-PAGE分析确定纯度,并使用生色底物测定法测量活性。还按照APC耐药性分析的要求测试了所有生产批次的APC延长正常人血浆aPTT的能力(10,11)。每个批次的测试结果均以aPTT(+/- APC)比(10nM APC)的形式提供。